Alumnado participante: alumnos de
1º ESO
Objetivo principal de la actividad: desarrollar la
competencia matemática y la comprensión de los números enteros (representación,
comparación, operaciones básicas y uso en contextos reales) mediante una
dinámica de juego cooperativo.
Área: Matemáticas – 1º ESO
- Competencias específicas:
CE1.- Interpretar, modelizar y resolver problemas de la vida cotidiana y
propios de las matemáticas, aplicando individual o colectivamente diferentes
estrategias y formas de razonamiento, explorando distintas soluciones posibles
y diferentes maneras de proceder.
CE2.- Analizar las soluciones de un
problema usando diferentes técnicas y herramientas.
CE5.- Reconocer y utilizar conexiones entre los diferentes elementos
matemáticos, interconectando conceptos y procedimientos.
CE8.- Comunicar de forma individual y en grupo conceptos, procedimientos y
argumentos matemáticos y presentes en situaciones cotidianas o académicas.
CE9.- Identificar y gestionar emociones, valorando el error como parte del
proceso de aprendizaje, adaptándose a situaciones de incertidumbre que ocurren
durante la resolución de retos.
CE10.- Desarrollar destrezas sociales reconociendo y respetando las
emociones y experiencias de los demás.
- Saberes básicos:
A.3. Sentido de las operaciones: A.3.3.1. Estrategias de
cálculo mental. A.3.3.2. Operaciones con números enteros. A.3.3.5. Propiedades
de las operaciones (suma, resta, multiplicación, división y potenciación):
cálculos de manera eficiente tanto mentalmente como de forma manual y con
calculadora.
F.1. Creencias, actitudes y emociones: F.1.3.1. Gestión emocional. F.1.3.2.
Estrategias de fomento de la curiosidad, la iniciativa, la perseverancia y la resiliencia en el aprendizaje de las matemáticas.
F.2. Trabajo en equipo y toma de decisiones. F.2.3.1. Técnicas cooperativas para optimizar el trabajo en equipo y compartir y construir conocimiento matemático. F.2.3.2. Conductas empáticas y estrategias de gestión de conflictos.
F.3. Inclusión, respeto y diversidad. F.3.3.1. Actitudes inclusivas y aceptación de la diversidad presente en el aula y en la sociedad. F.3.3.2 La contribución de las matemáticas al desarrollo de los distintos ámbitos del conoc miento humano sin olvidar la perspectiva de género.
·
Situaciones de
aprendizaje:
Esta actividad se inserta dentro de una
situación de aprendizaje basada en el juego como herramienta didáctica,
promoviendo aprendizajes funcionales y cooperativos.
Cómo se ha llevado a cabo:
- Tablero:
Se ha utilizado el tablero #MatLab.
·
Diseño y elaboración de las tarjetas por
el docente utilizando aplicaciones de google.
- Formación de equipos:
Los alumnos se organizan en grupos de 2 o 3 personas. Cada alumno lanza un dado y avanza según la mecánica tradicional del juego. - Desarrollo de la actividad: Cuando el
alumno cae en una casilla, coge una tarjeta al azar y resuelve la
operación que incluye, si responde correctamente avanza una casilla, si
falla retrocede a la anterior.
Tiempo de preparación:
Aproximadamente 5 horas (diseño y creación de
tarjetas, planificación del desarrollo y materiales). Número de sesiones con el
alumnado: 5 sesiones de 55/ 60 minutos.
Evaluación
El progreso
de los estudiantes en esta actividad se puede evaluar de varias formas:
Observación
directa: durante el juego, el docente
analiza cómo el alumnado resuelve las operaciones, si aplican correctamente las
operaciones con números enteros y cómo argumentan sus respuestas.
Fichas de
seguimiento donde los alumnos anotan sus respuestas
para luego revisarlas en grupo, permitiendo detectar errores y aclarar
conceptos.
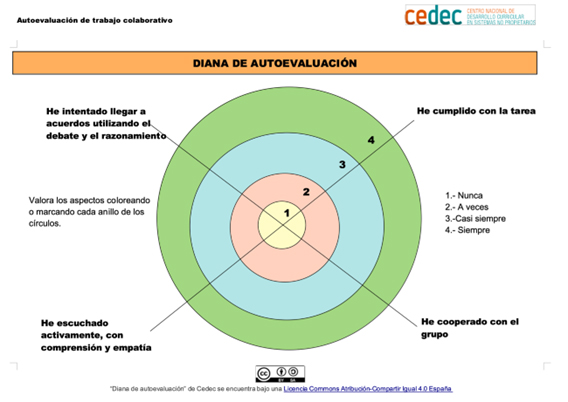
Autoevaluación
y reflexión: Al final de la actividad, los alumnos
comparten qué desafíos les resultaron más complicados y qué estrategias
utilizaron para resolverlos.
Preguntas
finales: Para reforzar el aprendizaje, se
realizó una pequeña evaluación con preguntas similares a las del juego,
asegurando que los conceptos trabajados fueron comprendidos.
.png)













.jpg)
